
皮膚・軟部組織再生研究
皮膚・軟部組織再生研究
皮膚の構造
皮膚は外胚葉由来の表皮と中胚葉由来の真皮から成り立っています。表皮は、体が乾燥しないように体内の水分を保ち、外界からの病原体や異物の侵入を防ぐ役割があります。表皮はほとんど表皮細胞からできており、表皮細胞が重層化(何重にも重なる)し、表面では角質を形成しています。表皮は1970年代に開発された自家培養表皮で再生可能であり、世界各国で製品化されて主に熱傷治療に使われています。本邦でも、自家培養表皮ジェイス®(株式会社ジャパン・ティッシュ・エンジニアリング)が2007年に重症熱傷を対象として承認され、2016年からは先天性巨大色素性母斑、2018年には表皮水疱症にも適用が拡大されました。一方、真皮は皮膚に力学的強度を持たせる役割があり、膠原線維(コラーゲン)を主体とした強靱な結合組織の中に、線維芽細胞などの細胞や、毛包などの皮膚付属器、血管、神経などが侵入する複雑な構造をとっています。このため、再生医療が発展してきた今日でも真皮の再生方法は確立していません。
二層性人工真皮の開発
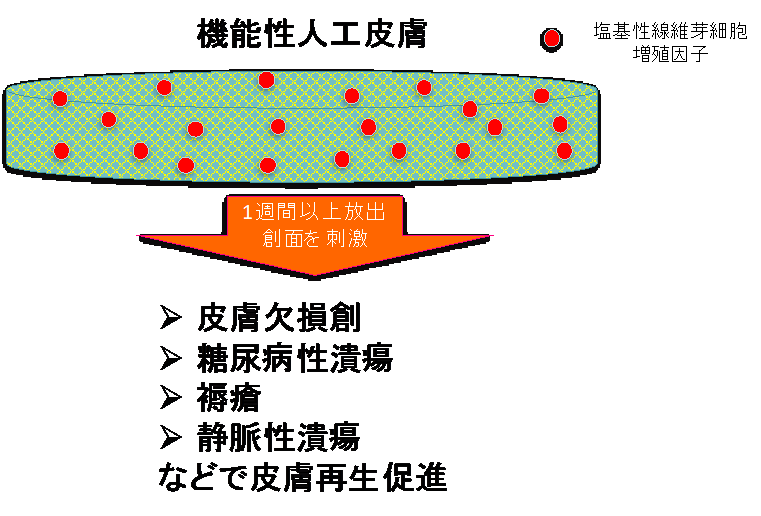
京都大学形成外科では、京都大学ウイルス・再生医科学研究所と共同で真皮再生に取り組んできました。コラーゲンスポンジをシリコーンフィルムで覆った二層構造をもつ人工皮膚(いわゆる二層性人工真皮)は1993年に製品化(ペルナックⓇ、グンゼ(株))されました。二層性人工真皮は真皮再生の際に足場として作用し、創面からコラーゲンスポンジの空隙内へ線維芽細胞や毛細血管が侵入増殖し、患者自身の擬似真皮が再生される、という画期的な効果があり、再生医療の先駆けとなりました。ただし、この疑似真皮の再生には2週間から3週間必要になるため、創の治癒機転が低下した糖尿病性潰瘍などの難治性皮膚潰瘍には使用することが困難でした。このため、傷を治す効果を高めるなんらかの方法を二層性人工真皮に付加する必要が生じました。代表的な方法として、持続陰圧療法がありますが、吸引装置を装着する必要があり、患者さんの歩行、体位などが制限されます。ここで、我々は2001年に本邦で承認された世界発の皮膚潰瘍治療薬である塩基性線維芽細胞増殖因子(フィブラストスプレーⓇ、科研製薬)を二層性人工真皮に吸着させる技術を考案し、2005年頃から新しい機能性人工真皮の基礎研究を開始しました。この結果、フィブラストスプレーⓇ通常投与量の1週間分から2週間分を含ませると、効果がおよそ10日間程度持続し、従来の人工皮膚と比較して1/2から1/3の期間で擬似真皮が形成されることを非臨床試験で確認し、2010年から京都大学医学部附属病院で医師主導治験を行い、実際の臨床でも機能性人工真皮が有効であることを証明しました。この結果、機能性人工真皮はペルナックGプラスⓇ(グンゼ(株))として2018年に医療機器として承認されました。今後、この機能性人工真皮を用いた際の臨床成績の評価や他の細胞成長因子との併用効果の検討、真皮以外の軟部組織(脂肪)再生研究などを行う予定です。
|
|
 |
| 機能性人工皮膚ペルナックGプラスⓇ |
参考文献
- Sugimoto R, Yamanaka H, Tsuge I, Katayama Y, Katsube M, Sakamoto M, Morimoto N. Two-stage skin grafting using a basic fibroblast growth factor-impregnated artificial dermis. Regen Ther. 2022 Aug 23;21:258-262. D
- Katsube M, Utsunomiya N, Katayama Y, Yamanaka H, Tsuge I, Sowa Y, Sakamoto M, Morimoto N. Interposition grafting of collagen-gelatin sponge impregnated with basic fibroblast growth factor in primary palatoplasty. Regen Ther. 2023 Aug 4;24:288-293.
- Sawaragi E, Yamanaka H, Li Y, Unzai T, Kawabata S, Nakano T, Katayama Y, Sakamoto M, Tabata Y, Morimoto N. Comparisons of the effects of silk elastin and collagen sponges on wound healing in murine models. Regen Ther. 2023 Sep 11;24:385-397.
- Morimoto N, Munisso MC, Le TM, Mitsui T, Kakudo N, Kusumoto K. A comparison of the wound healing process after the application of three dermal substitutes with or without basic fibroblast growth factor impregnation in diabetic mice. J Plast Reconstr Aesthet Surg. 2020 Aug;73(8):1547-1555.
- Notodihardjo SC, Morimoto N, Kakudo N, Mitsui T, Le TM, Tabata Y, Kusumoto K.Efficacy of Gelatin Hydrogel Impregnated With Concentrated Platelet Lysate in Murine Wound Healing. J Surg Res. 2019 Feb;234:190-201.
- Kakudo N, Morimoto N, Ogawa T, Taketani S, Kusumoto K. FGF-2 combined with bilayer artificial dermis composed of collagen matrix prompts generation of fat pad in subcutis of mice. Med Mol Morphol. 2019 Jun;52(2):73-81.
- Munisso MC, Morimoto N, Notodihardjo SC, Mitsui T, Kakudo N, Kusumoto K.Collagen/Gelatin Sponges (CGSs) Provide Both Protection and Release of bFGF: An In Vitro Study. Biomed Res Int. 2019 Feb 19;2019:4016351.
- Notodihardjo SC, Morimoto N, Kakudo N, Mitsui T, Le TM, Tabata Y, Kusumoto K. Comparison of the efficacy of cryopreserved human platelet lysate and refrigerated lyophilized human platelet lysate for wound healing. Regen Ther. 2018 Nov 20;10:1-9.
- Jinno C, Morimoto N,et al. A Comparison of Conventional Collagen Sponge and Collagen-Gelatin Sponge in Wound Healing. Biomed Res Int. 2016
- Morimoto N, Kuro A, et al. Combined use of fenestrated-type artificial dermis and topical negative pressure wound therapy for the venous leg ulcer of a rheumatoid arthritis patient. Int Wound J. 2016
- Morimoto N, Kakudo N Kusumoto K. Easy-to-Use Preservation and Application of Platelet-Rich Plasma in Combination Wound Therapy With a Gelatin Sheet and Freeze-Dried Platelet-Rich Plasma: A Case Report. Eplasty. 2016
- Watanabe M, Li H, Kim AG, Weilerstein A, Radu A, Davey M, Loukogeorgakis S, Sánchez MD, Sumita K, Morimoto N, et al. Complete tissue coverage achieved by scaffold-based tissue engineering in the fetal sheep model of Myelomeningocele. Biomaterials. 2016
- Notodihardjo PV, Morimoto N, et al. Gelatin hydrogel impregnated with platelet-rich plasma releasate promotes angiogenesis and wound healing in murine model. J Artif Organs. 2015
- Morimoto N, Kakudo N, et al. Exploratory clinical trial of combination wound therapy with a gelatin sheet and platelet-rich plasma in patients with chronic skin ulcers: study protocol. BMJ Open. 2015
- Kuro A, Morimoto N, et al. Combined use of fenestrated-type artificial dermis and topical negative-pressure wound therapy to treat the complex wound in the lower leg. J Plast Reconstr Aesthet Surg. 2015
- Morimoto N, Kakudo N, et al,. Comparison of neovascularization in dermal substitutes seeded with autologous fibroblasts or impregnated with bFGF applied to diabetic foot ulcers using laser Doppler imaging. J Artif Organs. 2014
- Ito R, Morimoto N, et al Laser Doppler imaging evaluation of adipogenesis after adipose tissue-derived stem cell implantation. J Artif Organs. 2013
- Morimoto N, Yoshimura K, et al.. Novel collagen/gelatin scaffold with sustained release of basic fibroblast growth factor: clinical trial for chronic skin ulcers. Tissue Eng Part A. 2013
- Ito R, Morimoto N, et al.. Efficacy of the controlled release of concentrated platelet lysate from a collagen/gelatin scaffold for dermis-like tissue regeneration. Tissue Eng Part A. 2013
- Morimoto N, Takemoto S, et al. Immediate evaluation of neovascularization in a grafted bilayered artificial dermis using laser Doppler imaging. Ann Plast Surg. 2012
- Ito R, Morimoto Net al. Adipogenesis using human adipose tissue-derived stromal cells combined with a collagen/gelatin sponge sustaining release of basic fibroblast growth factor. J Tissue Eng Regen Med. 2012
- Morimoto N, Ito T, et al. An exploratory clinical study on the safety and efficacy of an autologous fibroblast-seeded artificial skin cultured with animal product-free medium in patients with diabetic foot ulcers. Int Wound J. 2012
- Kanda N, Morimoto N, et al. Evaluation of a novel collagen-gelatin scaffold for achieving the sustained release of basic fibroblast growth factor in a diabetic mouse model. J Tissue Eng Regen Med. 2012
- Morimoto N, Yoshimura K, et al. An exploratory clinical trial for combination wound therapy with a novel medical matrix and fibroblast growth factor in patients with chronic skin ulcers: a study protocol. Am J Transl Res. 2012
- Ayvazyan A, Morimoto N, et al. Collagen-gelatin scaffold impregnated with bFGF accelerates palatal wound healing of palatal mucosa in dogs. J Surg Res. 2011
- Kanda N, Morimoto N, et al. Efficacy of novel collagen/gelatin scaffold with sustained release of basic fibroblast growth factor for dermis-like tissue regeneration. Ann Plast Surg. 2012
- Morimoto N, Takemoto S, et al. The utilization of animal product-free media and autologous serum in an autologous dermal substitute culture. J Surg Res. 2011
- Takemoto S, Morimoto N, et al. Preparation of collagen/gelatin sponge scaffold for sustained release of bFGF. Tissue Eng Part A. 2008
- Morimoto N, Saso Y, et al. Viability and function of autologous and allogeneic fibroblasts seeded in dermal substitutes after implantation. J Surg Res. 2005
先天性巨大色素性母斑に対する高圧処理母斑と
自家培養表皮を用いた皮膚再生治療
上述の様に、二層性人工真皮を用いた真皮再生研究を継続して行ってきましたが、この治療法の限界も明らかになってきました。自家培養表皮を二層性人工真皮を用いて再生させた疑似真皮の上に移植しても生着率が十分ではないことが報告(Matsumura H, et al. Burns. 2016 Jun;42(4):769-76)されています。先天性巨大色素性母斑は直径20cm以上の巨大なほくろ(色素性母斑)が生まれたときから存在する疾患で、2万人に1人程度に見られます。母斑組織は皮膚腫瘍組織であり、自家真皮構造の中に腫瘍細胞である母斑細胞が含まる構造となっています。したがって、腫瘍細胞である母斑細胞を取り除くあるいは死滅させることができれば母斑組織中の自家真皮を使って皮膚再生が行えるのではと考え研究を開始しました(先天性巨大色素性母斑の治療については、診療内容・巨大色素性母斑、もご覧ください)。この研究は国立循環器病研究センター研究所、大阪工業大学、関西医科大学と共同でおこなっています。我々は数千気圧を用いて細胞を死滅させる高圧処理に着目し、200MPa(2000気圧)で10分間高圧処理すれば、母斑組織及び皮膚に含まれるすべての細胞を死滅させること、しかも真皮構造は損傷されないことを発見しました。実際に、高圧処理を行った母斑組織では、色素を作り出す母斑細胞が死滅しているため、徐々に黒色色素が吸収されていくことを確認しています。先天性色素性母斑を対象とし、高圧処理により不活化した母斑組織の再移植と自家培養表皮を用いた皮膚再生治療法の安全性と有効性を確認する臨床研究を関西医科大学で2016年2月から2018年10月まで、10例の患者さんに参加していただき実施しました。この結果、不活化母斑の上に自家培養表皮が生着すること、また、黒色の色素も吸収されてなくなること、を確認しました(文献1)。また、この高圧処理を行う機器の医療機器としての承認、及び保険治療となることを目標とした医師主導治験を2021年7月に開始、2023年1月に終了しました。今後は高圧処理装置の医療機器承認を目指すと共に、骨や神経の再生にも応用する予定です。

Sakamoto M, Morimoto N, et al. Melanin pigments in the melanocytic nevus regress spontaneously after inactivation by high hydrostatic pressure. PLoS One. 2017 Nov 1;12(11):e0186958. より引用
参考文献
- Takiya M, Fushimi Y, Sakamoto M, Yoshida T, Ueno K, Nakajima S, Sakata A, Okuchi S, Otani S, Tagawa H, Morimoto N, Nakamoto Y. Incidence of neurocutaneous melanosis in Japanese pediatric patients with congenital melanocytic nevi. Sci Rep. 2023 Sep 30;13(1):16442.
- Masuno H, Sakamoto M, Katayama Y, Yamanaka H, Tsuge I, Katsube M, Saito S, Morimoto N. Additional treatments after curettage of congenital melanocytic nevi in the craniofacial region: A report from a single center in Japan. J Plast Reconstr Aesthet Surg. 2024 Nov;98:122-130.
- Matsuura Y, Sakamoto M, Ogino S, Arata J, Morimoto N. Inactivated NevusTissue with High Hydrostatic Pressure Treatment Used as a Dermal Substitute after a 28-Day Cryopreservation Period. Biomed Res Int. 2021 Feb 24;2021:3485189.
- Yamanaka H, Sawaragi E, Nakano T, Katayama Y, Ito T, Tada H, Hidaka Y, Morita S, Funakoshi C, Kinoshita A, Watanabe M, Tsuge I, Katsube M, Sakamoto M, Yamaoka T, Morimoto N. A high-hydrostatic pressure device for nevus tissue inactivation and dermal regeneration for reconstructing skin defects after giant congenital melanocytic nevus excision: a clinical trial. Regen Ther. 2023 Jun 30;24:167-173.
- Shoji-Pietraszkiewicz A, Sakamoto M, Katsube M, Ogino S, Tsuge I, Yamanaka H, Arata J, Morimoto N. Treatment of giant congenital melanocytic nevi with cultured epithelial autografts: Clinical and histopathological analysis. Regen Ther. 2021 Mar 14;18:1-6.
- Morimoto N, Mitsui T, Katayama Y, Kakudo N, Ogino S, Tsuge I, Sakamoto M, Hihara M, Kusumoto K. Cultured epithelial autografts for the treatment of large-to-giant congenital melanocytic nevus in 31 patients. Regen Ther. 2021 Jul 15;18:217-222.
- Morimoto N, Mitsui T, Sakamoto M, Mahara A, Yoshimura K, Arata J, Jinno C, Kakudo N, Kusumoto K, Yamaoka T. A Novel Treatment for Giant Congenital Melanocytic Nevi Combining Inactivated Autologous Nevus Tissue by High Hydrostatic Pressure and a Cultured Epidermal Autograft: First-in-Human, Open,Prospective Clinical Trial. Plast Reconstr Surg. 2021 Jul 1;148(1):71e-76e.
- Mitsui T, Morimoto N, Mahara A, Notodihardjo SC, Le TM, Munisso MC, Kakudo N, Yamaoka T, Kusumoto K. High Hydrostatic Pressure Therapy Annihilates Squamous Cell Carcinoma in a Murine Model. Biomed Res Int. 2020 Mar 7;2020:3074742.
- Mitsui T, Morimoto N, Mahara A, Notodihardjo SC, Le TM, Munisso MC, Moriyama M, Moriyama H, Kakudo N, Yamaoka T, Kusumoto K. Exploration of the Pressurization Condition for Killing Human Skin Cells and Skin Tumor Cells by High Hydrostatic Pressure. Biomed Res Int. 2020 Jan 30;2020:9478789.
- Masuoka H, Morimoto N, Mahara A, Sakamoto M, Mitsui T, Kakudo N, Kusumoto K, Yamaoka T. Simple and efficient method for consecutive inactivation-cryopreservation of porcine skin grafts. J Artif Organs. 2020 Jun;23(2):147-155.
- Le TM, Morimoto N, Mitsui T, Notodihardjo SC, Munisso MC, Kakudo N, Kusumoto K. The sustained release of basic fibroblast growth factor accelerates angiogenesis and the engraftment of the inactivated dermis by high hydrostatic pressure. PLoS One. 2019
- Sakamoto M, Morimoto N, Jinno C, Mahara A, Ogino S, Suzuki S, Kusumoto K,Yamaoka T. Melanin pigments in the melanocytic nevus regress spontaneously after inactivation by high hydrostatic pressure. PLoS One. 2017
- Morimoto N, Mahara A, Jinno C, Ogawa M, Kakudo N, Suzuki S, Fujisato T,Kusumoto K, Yamaoka T. The superiority of the autografts inactivated by high hydrostatic pressure to decellularized allografts in a porcine model. J Biomed Mater Res B Appl Biomater. 2017
- Morimoto N, Jinno C, Mahara A, Sakamoto M, Kakudo N, Inoie M, Fujisato T, Suzuki S, Kusumoto K, Yamaoka T. The Alteration of the Epidermal Basement Membrane Complex of Human Nevus Tissue and Keratinocyte Attachment after High Hydrostatic Pressurization. Biomed Res Int. 2016
- Morimoto N, Jinno C, Sakamoto M, Kakudo N, Yamaoka T, Kusumoto K. An Exploratory Clinical Trial of a Novel Treatment for Giant Congenital Melanocytic Nevi Combining Inactivated Autologous Nevus Tissue by High Hydrostatic Pressure and a Cultured Epidermal Autograft: Study Protocol. JMIR Res Protoc. 2016
- Morimoto N, Jinno C, Mahara A, Kakudo N, Fujisato T, Kusumoto K, Suzuki S,Yamaoka T. Verification of the Inactivation of Melanocytic Nevus in vitro Using a Newly Developed Portable High Hydrostatic Pressure Device. Cells Tissues Organs.2016
- Morimoto N, Mahara A, Jinno C, Ogawa M, Kakudo N, Suzuki S, Kusumoto K,Fujisato T, Yamaoka T. An evaluation of the engraftment and the blood flow of porcine skin autografts inactivated by high hydrostatic pressure. J Biomed Mater Res B Appl Biomater. 2017
- Liem PH, Morimoto N, Mahara A, Jinno C, Shima K, Ogino S, Sakamoto M, Kakudo N, Inoie M, Kusumoto K, Fujisato T, Suzuki S, Yamaoka T. Preparation of Inactivated Human Skin Using High Hydrostatic Pressurization for Full-Thickness Skin Reconstruction. PLoS One. 2015
- Jinno C, Morimoto N, Mahara A, Liem PH, Sakamoto M, Ogino S, Kakudo N, Inoie M, Fujisato T, Kusumoto K, Suzuki S, Yamaoka T. Inactivation of Human Nevus Tissue Using High Hydrostatic Pressure for Autologous Skin Reconstruction: A Novel Treatment for Giant Congenital Melanocytic Nevi. Tissue Eng Part C Methods. 2015
- Morimoto N, Mahara A, Shima K, Ogawa M, Jinno C, Kakudo N, Kusumoto K,Fujisato T, Suzuki S, Yamaoka T. The rapid inactivation of porcine skin by applying high hydrostatic pressure without damaging the extracellular matrix.Biomed Res Int. 2015
- Mahara A, Morimoto N, Sakuma T, Fujisato T, Yamaoka T. Complete cell killing by applying high hydrostatic pressure for acellular vascular graft preparation.Biomed Res Int. 2014
京都大学大学院医学研究科 形成外科学
教授 森本尚樹

