
人工血管の研究
人工血管の研究
- 下肢血行再建用小口径人工血管の開発(国立循環器病研究センター研究所)
人工血管の進歩は新たな血管手術の可能性を生み出します。例えば大動脈瘤の手術は保存同種血管に関する研究があって1950年代に初めて可能となり、その後のポリエステル繊維性の大口径人工血管の開発によって安定した成績が得られるようになりました。更に、その後のテフロン繊維製の小口径人工血管の開発によって、透析が必要な患者さんは、自身の血管が細すぎる場合でも人工血管を介した透析を受けることが可能になりました(図1左)。また、動脈硬化などで下肢の動脈が狭窄あるいは閉塞した患者さんには、患者さん自身の太ももから静脈(自己静脈)を採取して病変部をまたぐように移植(バイパス手術)することで足先の血流を改善させる手術が行われますが、膝より上部のバイパス手術においては自己静脈の代わりに小口径人工血管を用いることができます(図1右)。しかし現在、これら透析用シャントや下肢の血行再建用の小口径人工血管(内径4〜6mm)の開存率は必ずしも満足できるレベルではなく、多くの症例で開存性維持のための二次的処置が必要になります。開存性に優れた小口径人工血管があれば、血行再建手術の恩恵を受けられる患者さんを増やすことができると考えられています。
国立循環器病研究センター研究所生体医工学部の山岡哲二部長らは、下肢血行再建に使用できる、しかも膝より下部の細い動脈まで吻合可能なサイズの人工血管を開発することを目標とし、近年、内径2mm長さ30cmという世界に類のないサイズの人工血管をブタに移植して開存させることに成功しました(http://www.ncvc.go.jp/res/divisions/biomedical_engineering/13-theme01.html)。ダチョウの血管を材料とするその人工血管の特徴は、ヒトに移植しても過剰な免疫反応を引き起こさないように脱細胞化(細胞成分だけを取り出して血管の形だけを残すこと)されていることと、内腔に固定化された特殊な人工ペプチドの働きによって移植後に患者さん自身の細胞を取り込みやすいということです(図2)。この人工血管は移植後に患者さん自身の細胞とそれによって形成される組織に徐々に置き替わり、最終的には本物の血管になることが期待できる再生型の人工血管です。現在、当科の森本尚樹教授を中心に多施設でチームを構築して臨床研究を行うべく準備中です。
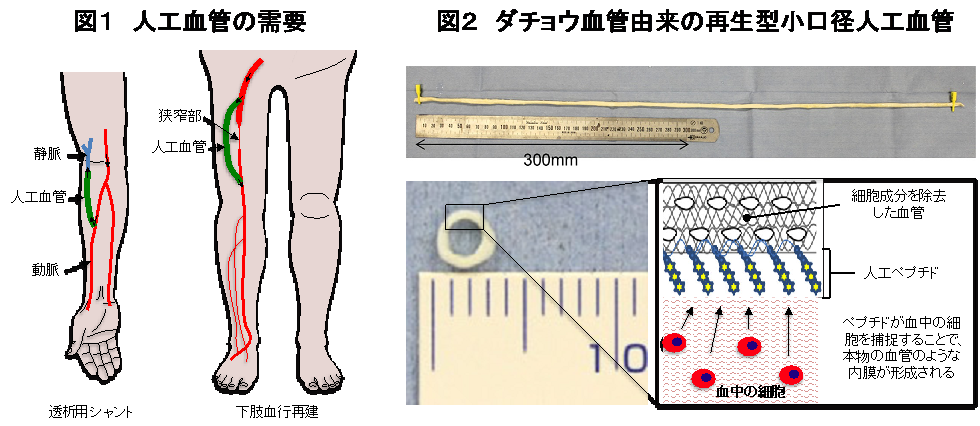
下肢血行再建用小口径人工血管の開発
- マイクロサージャリー用人工血管に関する研究
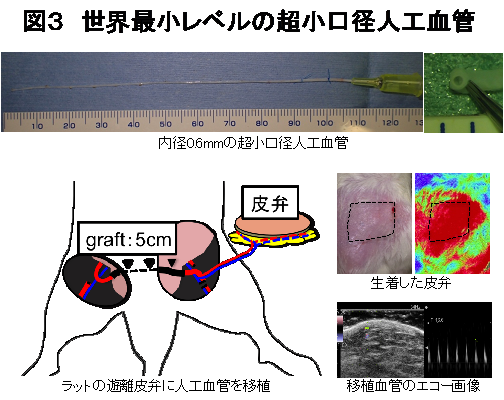
形成外科では顕微鏡を用いてさらに細い口径(内径0.5mm〜2mm程度)の血管を吻合する手術(マイクロサージャリー)が日常的に行われており、これらの手術でも使用できるような超小口径の人工血管があればより質の高い手術が可能になります。例えば切断された指をつなぐためには内径1mm未満の血管を吻合しますが、受傷時に傷んだ血管をそのまま吻合してもすぐに閉塞してしまうので、傷んだ血管は切除して代わりの血管(一般的には自己静脈)で置き換えます。マイクロサージャリー用人工血管があれば患者さん自身の血管を採取する必要がなく手術時間も短時間で済みます。
京都大学形成外科では、このようなマイクロサージャリー用の人工血管に関して2016年度から国立循環器病研究センター研究所との共同研究を行っています。2018年度にはダチョウ血管由来人工血管の技術を応用した内径0.6mm長さ5cmの世界最小レベルの超小口径人工血管を作製し、これをラットに移植して良好な開存を得ることに成功しました。一旦切り離されたラットの皮膚組織(皮弁)の血管に吻合されたこの人工血管は3週間もの間皮弁に安定した血液を供給し、その結果、皮弁は生着しました(図3)。
参考文献
- M.C. Munisso and T. Yamaoka, Circulating Endothelial Progenitor Cells in Small-diameter Artificial Blood Vessel, (Review) Journal of Artificial Organs, in press (2019)
- H. Yamanaka, T. Yamaoka, A. Mahara, N. Morimoto, and S. Suzuki, Tissue-engineered submillimeter-diameter vascular grafts for free flap survival in rat model, Biomaterials, 179, 156-163 (2018)
- M.C. Munisso and T. Yamaoka, Novel peptides for small-caliber graft functionalization selected by a phage display of endothelial-positive/platelet-negative combined selection, Journal of Materials Chemistry B, 5, 9354-9364 (2017)
- A. Mahara, S. Somekawa, N. Kobayashi, Y. Hirano, Y. Kimura, T. Fujisato, and T. Yamaoka, Tissue-Engineered Acellular Small Diameter Long-bypass Grafts with neointima-inducing activity, Biomaterials, 58, 54-62 (2015)
文責: 京都大学大学院医学研究科 形成外科学 山中浩気
